Dosierung und Anwendung
Patientenindividuelle Dosierung auf Basis von urodynamischen Parametern
Die neurogene Detrusorüberaktivität ist sehr individuell und die Gesamttagesdosis von VESOXX® wird entsprechend urodynamischer Parameter für jeden Patient*in individuell bestimmt.1
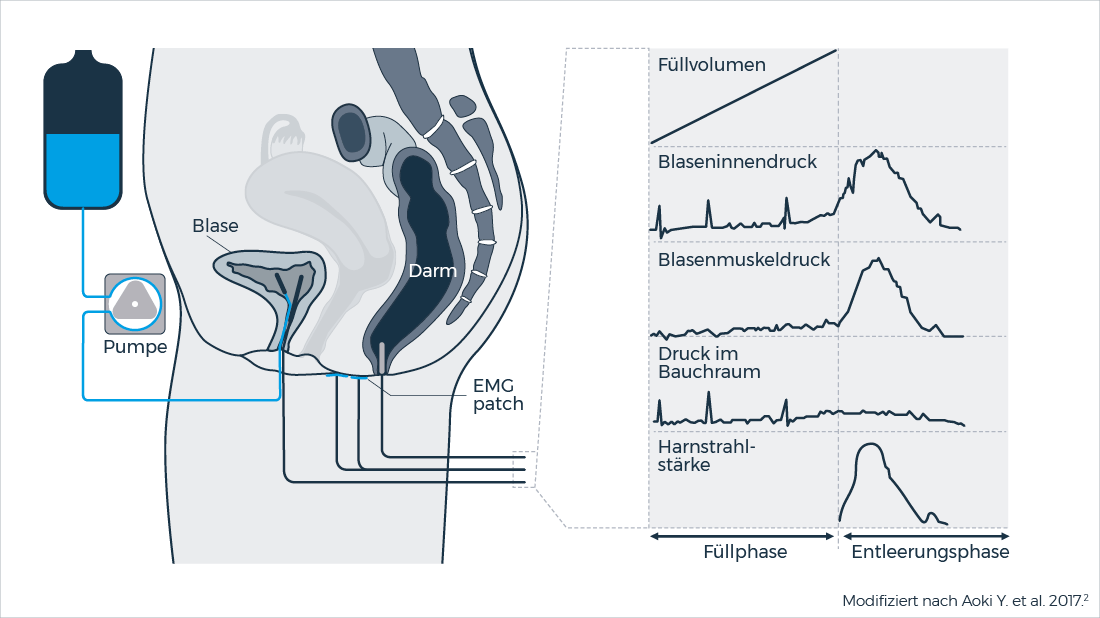
Vor Therapiebeginn mit VESOXX® wird eine Urodynamik durchgeführt und entsprechend eine individuelle Dosierung festgelegt. Mit einer Konzentration von 0,1 % Oxybutynin-Hydrochlorid ermöglicht VESOXX® die Instillation von nur 10 ml, um eine Dosis von 10 mg zu erreichen (1 mg/ml).
Eine Dosisanpassung läuft unter engmaschiger urodynamischer Kontrolle ab. Abhängig vom klinischen Bild sollte eine Urodynamik in regelmäßigen Abständen durchgeführt werden.
| Altersgruppe | Alter [Jahre] | Empfohlene tägliche Startdosis [mg] | Empfohlene Gesamttagesdosis [mg] |
|---|---|---|---|
| Kinder |
|
|
|
| Jugendliche |
|
|
|
| Erwachsene |
|
|
|
| Ältere Patient*innen |
|
|
|
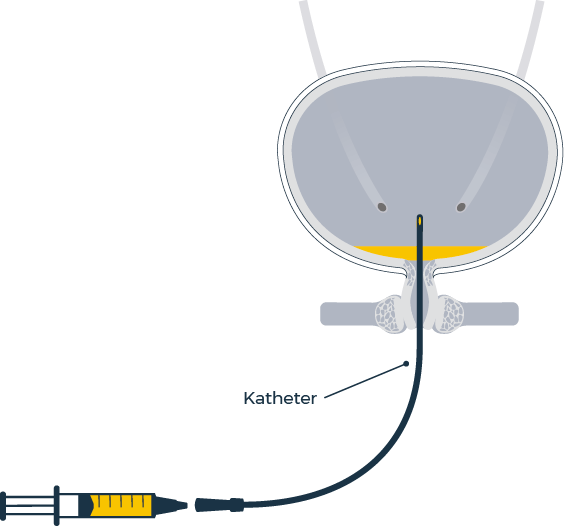
Integration der VESOXX®-Therapie in die tägliche Routine
VESOXX® wird nach Entleerung der Blase ein- bis mehrmals täglich in die Blase instilliert, dabei sind die folgenden Schritte durchzuführen:1
- Aseptischen intermittierenden Selbstkatheterismus durchführen
- VESOXX® Fertigspritze mit dem Katheter verbinden
- Erforderliche Menge direkt in die Blase instillieren
- Katheter entfernen
- Einzelne Materialien entfernen
- VESOXX® Fachinformation. www.swissmedicinfo.ch; Stand November 2023
Vollständige Kopien der Referenzen können bei Bedarf bei Melisana AG angefordert werden.
Therapie bei Erwachsenen
Die Wirksamkeit und Verträglichkeit von intravesikalem Oxybutynin wurde bereits in mehreren Studien bei Erwachsenen demonstriert.
Wirksamkeit und Verträglichkeit von intravesikalem Oxybutynin im Vergleich zur oralen Therapie
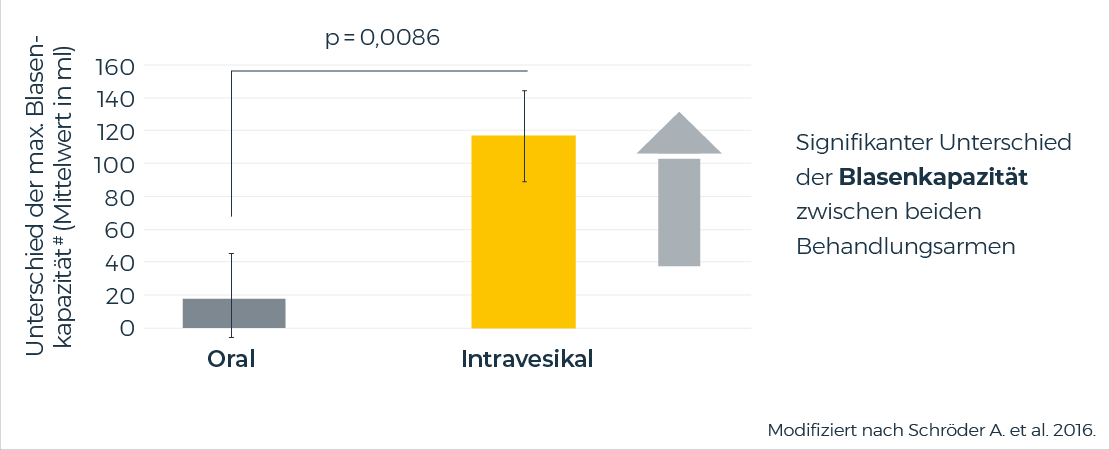
In einer randomisierten, prospektiven, aktiv kontrollierten, multizentrischen Open-Label-Studie zeigte intravesikales Oxybutynin (1 mg/ml) einen starken Effekt auf das primäre Wirksamkeitskriterium der maximalen Blasenkapazität nach 28-tägiger Behandlung.
Im Vergleich zur Baseline (nicht im Vergleich zwischen den beiden Behandlungsarmen) verbesserte die Behandlung mit intravesikalem Oxybutynin signifikant sekundäre Wirksamkeitskriterien, darunter
- den maximalen Detrusordruck,
- die Detrusor-Compliance sowie
- die Anzahl der täglichen unfreiwilligen Urinverluste.
Intravesikales Oxybutynin-HCI (1 mg/ml) war in Bezug auf den primären Wirksamkeitsparameter (Blasenkapazität) oralem Oxybutynin signifikant überlegen.
Nebenwirkungen traten im Vergleich zu oralem Oxybutynin seltener auf
Ca. 27 %§ weniger Patienten mit Nebenwirkungen unter intravesikalem Oxybutynin verglichen mit oralem Oxybutynin
(55,6 % vs. 82,4 %).
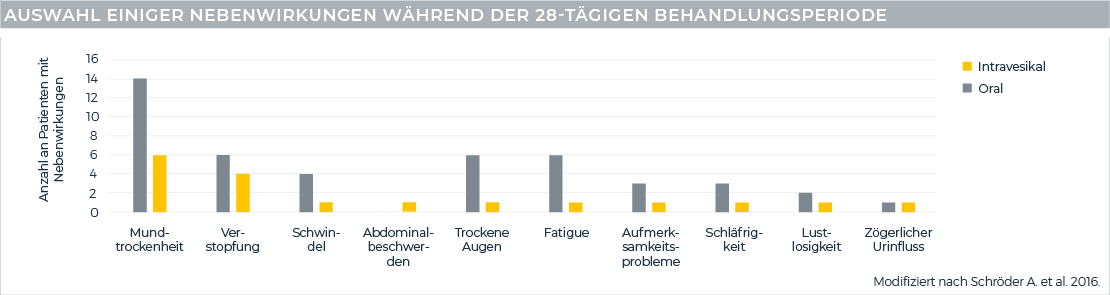
Durch die direkte Applikation und durch einen geringeren First-Pass-Metabolismus traten weniger Nebenwirkungen unter intravesikalem Oxybutynin (1 mg/ml) im Vergleich zur oralen Therapie auf. Es wurden keine schwerwiegenden Nebenwirkungen beobachtet.
§ Der Wert wurde anhand der angegebenen Studiendaten berechnet.
Patienten erhielten 28 Tage lang entweder 3 x täglich 10 mg steril hergestelltes Oxybutynin-Hydrochlorid (1 mg/ml) oder 3 x täglich 5 mg orales Oxybutynin.
Schröder A. et al., Efficacy, Safety, and Tolerability of Intravesically Administered 0.1% Oxybutynin Hydrochloride Solution in Adult Patients With Neurogenic Bladder: A Randomized, Prospective, Controlled Multi-Center Trial. Neurourol Urodyn. 2016; 35(5):582–588; (randomisierte, prospektive, aktiv kontrollierte, multizentrische Open-Label-Studie mit intravesikalem Oxybutynin (n = 18) und oralem Oxybutynin (n = 17)).
Vollständige Kopien der Referenzen können bei Bedarf bei Melisana AG angefordert werden.
Wirksamkeit und Verträglichkeit der Kombinationstherapie
In einer prospektiven Open-Label-Studie wurde die Effektivität und Verträglichkeit einer Kombinationstherapie von intravesikalem Oxybutynin (1 mg/ml) und oralem Oxybutynin untersucht.
Die urodynamische Untersuchung zeigte eine deutliche Reduktion des mittleren max. Detrusordrucks. 21/25 der Patienten hatten einen Detrusordruck von unter 40 cm H2O.
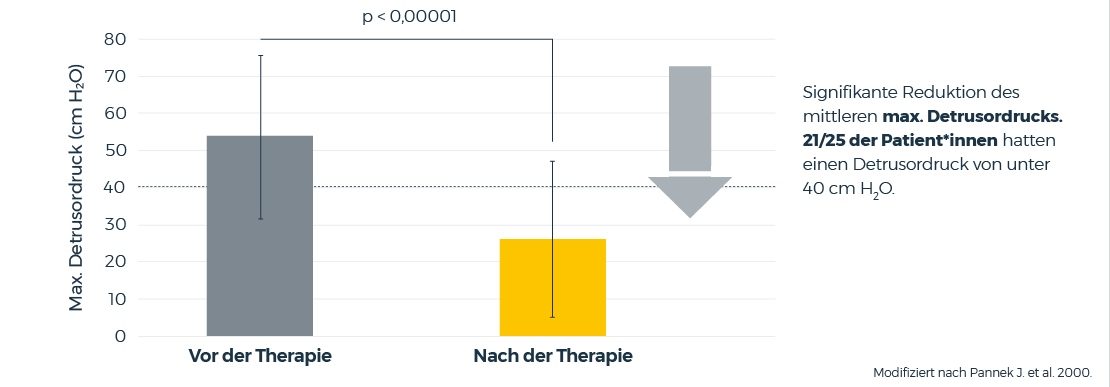
Weitere Therapieerfolge sind die Verbesserung des Blasenspeichervolumens, Kontinenz bei 79 % der vorher inkontinenten Patienten und eine Reduktion der Windelanzahl um mehr als 50 % bei 2 Patienten, die Windeln benötigten.
Die Kombinationstherapie erzielte hohe Akzeptanz bei Patient*innen.
Nierenschäden sowie schwerwiegende Nebenwirkungen traten nicht auf.
Patienten erhielten 3 x täglich 15 mg intravesikales Oxybutynin und 4 x täglich 5 mg orales Oxybutynin. Lag der Detrusordruck nach 6-wöchiger Behandlungszeit im Normalbereich, wurde die orale anticholinerge Medikation schrittweise reduziert.
Pannek J. et al., Combined intravesical and oral oxybutynin chloride in adult patients with spinal cord injury. Urology. 2000; 55(3):358–362; (prospektive Open-Label-Studie mit intravesikalem Oxybutynin in Kombination mit oralem Oxybutynin, n = 25).
Vollständige Kopien der Referenzen können bei Bedarf bei Melisana AG angefordert werden.
Therapie bei Kindern
Therapieerfolge nach bis zu 15 Jahren Behandlungszeit
Ergebnisse einer retrospektiven Kohortenstudie mit Kindern und Jugendlichen demonstrierten anhaltende Wirksamkeit und gute Verträglichkeit von intravesikalem Oxybutynin nach bis zu 15 Jahren ± 1 Jahr Behandlungszeit. Die Kinder nahmen zuvor an einer prospektiven zweijährigen Open-Label-Studie teil.
Intravesikales Oxybutynin zeigte eine anhaltende Wirkung und reduzierte den maximalen Detrusordruck im Mittel auf 24,5 ±14,4 cm H2O.
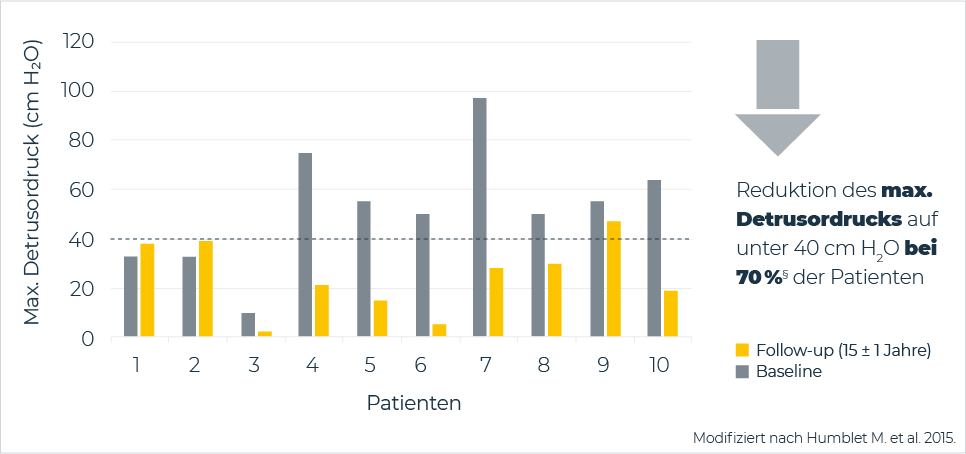
Außerdem zeigten sich Verbesserungen in der zystometrischen Blasenkapazität und eine signifikante Steigerung der Blasen-Compliance.
Die langfristige Behandlung ging mit einer guten Verträglichkeit einher und Patienten waren zufrieden mit ihrem Kontinenzstatus.
Die klinische Studie demonstrierte eine anhaltende Wirksamkeit von intravesikalem Oxybutynin (1 mg/ml) bei Kindern und Jugendlichen mit einer Therapiedauer von etwa 15 Jahren. Die Therapie war gut verträglich und renale sowie infektiöse Komplikationen wurden verhindert.
§ Der Wert wurde anhand der angegebenen Studiendaten berechnet.
Patienten erhielten während der Verlängerungsphase 2 x täglich 5 mg intravesikales Oxybutynin (1 mg/ml). Gute Verträglichkeit: Keine Angaben von lokalen oder systemischen Nebenwirkungen.
Humblet M. et al., Long-term outcome of intravesical oxybutynin in children with detrusor-sphincter dyssynergia: with special reference to age dependent parameters. Neurourol Urodyn. 2015; 34(4):336–342; (retrospektive Kohortenstudie mit intravesikalem Oxybutynin, n = 10 bei Re-Evaluation).
Vollständige Kopien der Referenzen können bei Bedarf bei Melisana AG angefordert werden.

